Další možnost v léčbě progrese chronického onemocnění ledvin u pacientů s DM2

Další možnost v léčbě progrese chronického onemocnění ledvin u pacientů s diabetem 2. typu
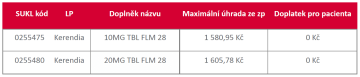
Dovolujeme si Vás informovat, že od 1. 9. 2023 je léčivý přípravek Kerendia® (s účinnou látkou finerenon) hrazen z prostředků veřejného zdravotního pojištění.1
Navzdory standardní léčbě, která kompenzuje krevní tlak a glykémii, může chronické onemocnění ledvin (CKD) u pacientů s diabetem 2. typu (DM2) nadále progredovat.
Ke zpomalení progrese CKD je důležité ovlivnit u pacientů s DM2 i zánětlivé a fibrotické faktory.2
Terapeutická indikace3
Přípravek Kerendia je indikován k léčbě chronického onemocnění ledvin (s albuminurií) spojeného s diabetem 2. typu u dospělých pacientů.
Indikační omezení úhrady přípravku Kerendia® od 1. 9. 20231
P: Finerenon je hrazen jako přídatná terapie u dospělých pacientů s diabetem 2. typu a současným diabetickým onemocněním ledvin (DKD) stupně 3 a 4, s odhadovanou glomerulární filtrací (eGFR) v rozmezí 25 až méně než 60 ml/min/1,73m2
a albuminurií (alespoň 33,9 g/mol, odpovídá 300 mg/g kreatininu),
kteří jsou
1) léčeni maximálně tolerovanou dávkou inhibitoru angiotenzin-konvertujícího enzymu (ACEI) nebo blokátoru receptoru typu 1 pro angiotenzin II (ARB) a u kterých není možná nebo vhodná léčba gliflozinem.
2) léčeni maximálně tolerovanou dávkou inhibitoru angiotenzin-konvertujícího enzymu (ACEI) nebo blokátoru receptoru typu 1 pro angiotenzin II (ARB) a gliflozinem.
Z prostředků veřejného zdravotního pojištění je hrazena maximálně 1 tableta denně.
Léčba finerenonem je hrazena do poklesu eGFR pod 15 ml/min/1,73m2 nebo do transplantace ledviny.
Specializace předepisujícího lékaře1
E/NEF, DIA, INT
ATC skupina1
C03DA05
Profil pacienta vhodný na zahájení léčby přípravkem Kerendia®
(v souladu s indikačním omezením úhrady)1
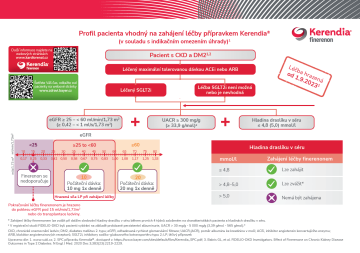
Dávkování přípravku Kerendia®3

* Pokud je hladina draslíku v séru > 4,8 až 5,0 mmol/ l, lze zvážit zahájení léčby přípravkem Kerendia® při dalším sledování hladiny draslíku v séru během prvních 4 týdnů, a to na základě charakteristik pacienta a hladin draslíku v séru.3
a V registrační studii FIDELIO-DKD byli pacienti vybíráni na základě prokázané perzistentní albuminurie, UACR > 30 mg/g - 5 000 mg/g (3,39 g/mol - 565 g/mol). 2
P, vykazovací limit (indikační omezení úhrady)1
E, preskripční omezení (Léčivý přípravek s tímto preskripčním omezením může předepsat k úhradě ze zdravotního pojištění pouze odborný lékař, který je uveden v preskripčním omezení a má s pojišťovnou uzavřenou smlouvu o poskytování této odborné zdravotní péče. Preskripci nemůže delegovat na jiného lékaře.) 1
NEF, nefrolog; DIA, diabetolog; INT, internista; zp, zdravotní pojištění; ATC, anatomicko-terapeuticko-chemická skupina; LP, léčivý přípravek; CKD, chronické onemocnění ledvin; DM2, diabetes mellitus 2. typu; eGFR, odhadovaná rychlost glomerulární filtrace; UACR,(ACR), poměr albuminu ke kreatininu v moči; ACEi, inhibitor angiotenzin konvertujícího enzymu; ARB, blokátor angiotenzinových receptorů; SGLT2i, inhibitory sodíko-glukozového kotransportéru typu 2
Reference: 1. www.sukl.cz; 2. Bakris GL., etal; FIDELIO-DKD Investigators. N ENG J Med. 2020;383(23):2219-2229; 3. SPC přípravku Kerendia®, dostupné z https://www.bayer.com/sites/default/files/Kerendia_SPC.pdf
Lék Kerendia 10 mg potahované tablety a Kerendia 20 mg potahované tablety jsou vázany na lékařský předpis. Přípravky jsou hrazeny z prostředků veřejného zdravotního pojištění.
Aktuální výši a podmínky úhrady naleznete na www.sukl.cz. Před předepsáním léčivých přípravků si pečlivě přečtěte úplnou informaci o přípravcích. Souhrny údajů o přípravcích i s informacemi, jak hlásit nežádoucí účinky najdete na www.bayer.cz, nebo obdržíte na adrese BAYER s.r.o., Siemensova 2717/4, 155 00 Praha 5, Česká republika.
Pro souhrn údajů o přípravku Kerendia® 10 mg potahované tablety a Kerendia® 20 mg potahované tablety klikněte zde.
8/2023 PP-KER-CZ-0150-1